इस पोस्ट में हम आक्सीकरण एवं अपचयन, तत्वों का आवर्ती वर्गीकरण, आधुनिक आवर्त नियम के बारे में जानेंगे और साथ हीरसायन विज्ञान कक्षा 12के विभिन्न प्रकारों को अन्य पोस्ट आप जान सकेंगे
Table of Contents
आक्सीकरण एवं अपचयन
- ऑक्सीकरण – किसी अभिक्रिया में पदार्थ की आक्सीजन संख्या में वृध्दि या हाइड्रोजन की संख्या में कमी होती है , टो इसे आक्सीकरण कहते हैं |
- परमाणु , आयनों या अणुओं द्वारा एक से अधिक इलेक्ट्रान का त्याग ऑक्सीकरण कहलाता है |
- वह प्रक्रिया जिसमें किसी तत्व की आक्सीकरण या उपचयन कहलाती है |
- अपचयन – किसी अभिक्रिया में पदार्थ की आक्सीकरण संख्या में कमी या हाइड्रोजन की संख्या में वृध्दि अपचयन कहलाती है |
- परमाणु आयनों या द्वारा एक या अधिक इलेक्ट्रान ग्रहण करना अर्थात् धनावेश घट जाना अपचयन या अवकरण कहलाता है |
- वह अभिक्रिया जिसमें किसी तत्व की ऑक्सीकरण संख्या घटती है अपचयन कहलाती हैं |
- आक्सीकरक – अभिक्रिया में जिस पदार्थ का अपचयन होता है उसे ऑक्सीकरक कहते हैं |
जैसे –
- पोटैशियम परमैंगनेट (KMnO4)
- पोटैशियम डाइक्रोमेट (K2Cr2O7)
- नाइट्रिक अम्ल ( HNO3)
- हैलोजन ( Cl2 , Br2 , I2 )
- हाइड्रोजन पराक्साइड ( H2O2 ) आदि |
- वह पदार्थ जो दुसरे पदार्थ को ऑक्सीकरण संख्या बढा देता है ऑक्सीकरण कहलाते हैं |
- अपचयन या अवकारक – जिस पदार्थ का ऑक्सीकरण होता है उसे अपचयन या अवकारक कहते हैं | जैसे –
- सल्फर डाइआक्साइड ( SO2 )
- पोटैशियम आयोडाइड ( KI )
- हाइड्रोजन सल्फाइड ( H2S )
- स्टैनस क्लोराइड ( SnCl2 )
- हाइड्रोजन की ऑक्सीकरण संख्या +1 होती है |
- सोडियम व पोटैशियम की ऑक्सीकरण संख्या +1 होती है |
- आक्सीजन के लिए -2 होती है | पराक्साइड जिसमें -1 तथा जिसमें +2 होती है |
- मैग्नीशियम , कैल्शियम व स्ट्रांशियम के लिए +2 होती है |
- फ्लोरीन के लिए ऑक्सीकरण संख्या सदैव -1 होती है और उदासीन अणु के लिए शून्य होती है |
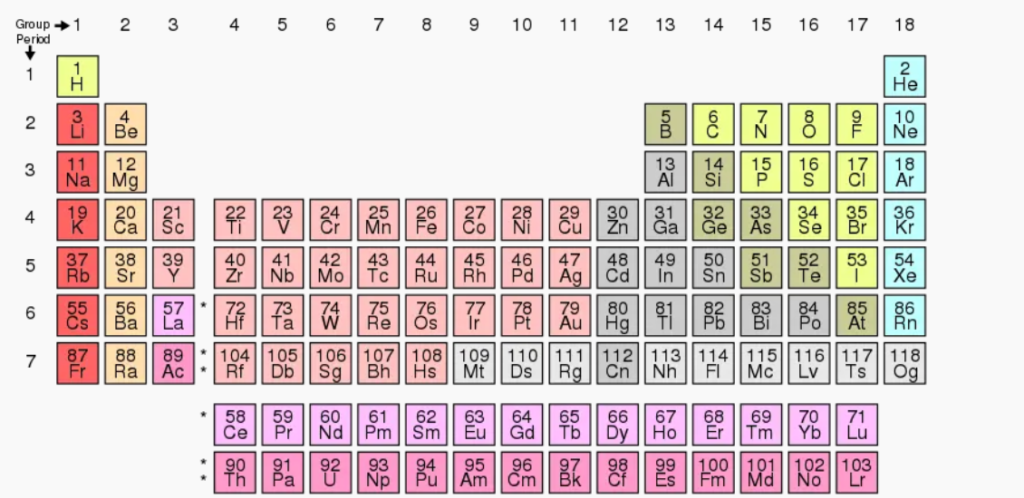
आधुनिक आवर्त नियम : तत्वों का आवर्ती वर्गीकरण
- मेंडलीफ का आवर्त नियम – उन्नीसवीं शताब्दी के मध्य में महान रशियन वैज्ञानिक डी० आई० मेंडलीफ ने विभिन्न तत्वों तथा उनके यौगिकों के तुलनात्मक अध्ययन के आधार पर एक नियम दिया जिसे मेंडलीफ का आवर्त नियम कहते हैं |
- मेंडलीफ के आवर्त नियम के अनुसार तत्वों के भौतिक एवं रासायनिक गुण इनके परमाणु भारों के आवर्त फलन होते हैं |
- मेंडलीफ द्वारा निर्मित आवर्त सारणी में 9 वर्ग तथा 7 आवर्त है |
- मेंडलीफ की आवर्त सारणी तत्वों के रासायनिक गुणधर्मों पर आधारित हैं |
आधुनिक आवर्त नियम : मेंडलीफ की आवर्त सारणी की विशेषताएँ
- इसमें अज्ञात तत्व के लिए रिक्त स्थान छोड़े गये |
- समान गुणधर्मों वाले तत्वों को एक साथ स्थान मिल गया |
- विगत व्यवस्था को परिवर्तित किये बिना ही अक्रिय गैसों का पता लगने पर उन्हें अलग समूह में रखा जा सकता था |
मेंडलीफ की आवर्त सारणी के दोष
- इससे समस्थानिकों की स्थिति स्पष्ट नहीं थी |
- हाइड्रोजन का स्थान निश्चित नहीं था |
- 8 वें वर्ग में तीन तत्वों को एक साथ समूहित करना
- दुर्लभ मृदा तत्वों को एक ही साथ वर्ग III A में रखा गया है |
- धातु एवं अधातु तत्वों के बीच कोई स्पष्ट विभाजन नहीं है |
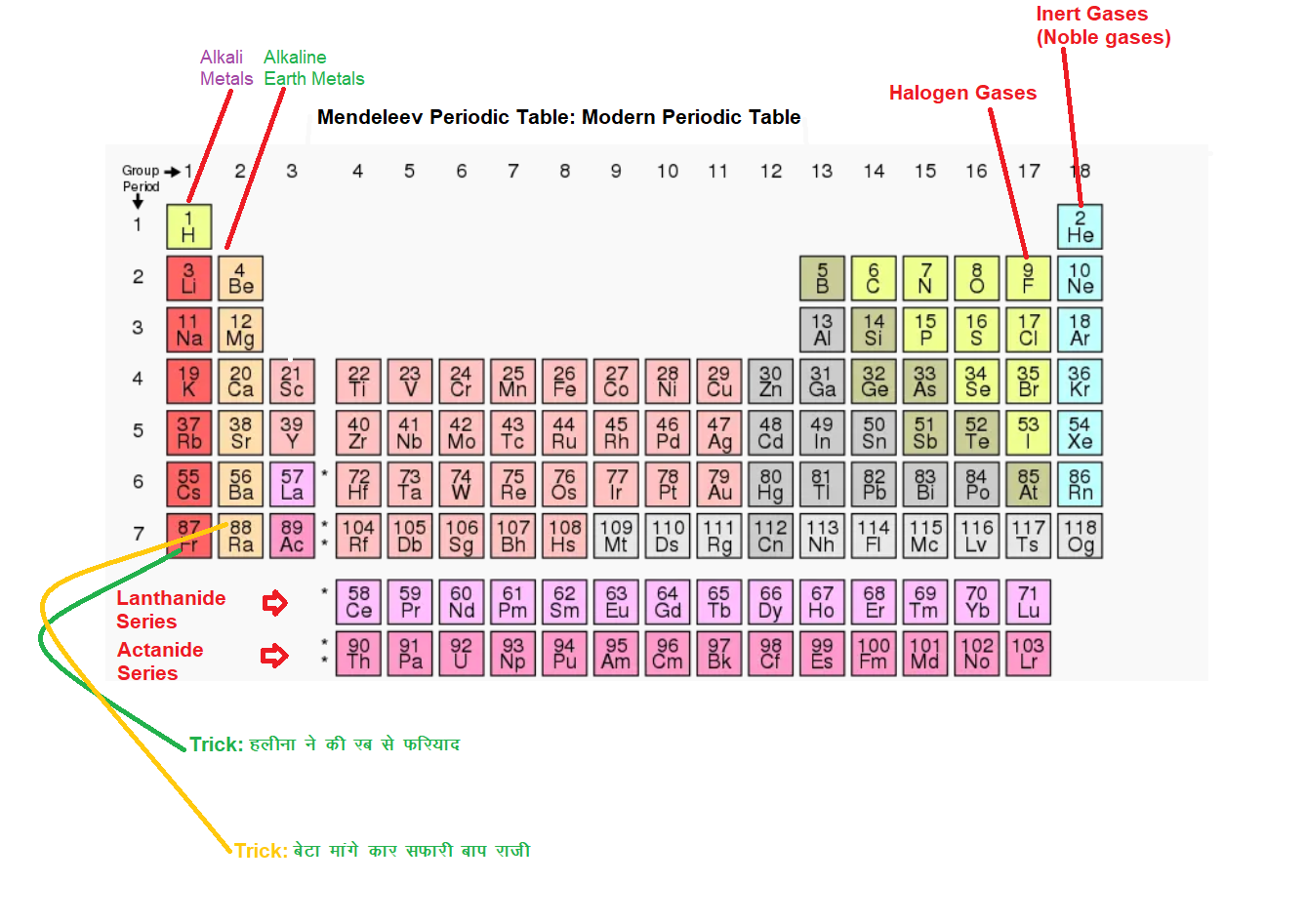
आधुनिक आवर्त नियम
आधुनिक आवर्त नियम
- आधुनिक आवर्त सारणी – 1913 ई० का मोसले ने एक नियम दिया जिसके अनुसार तत्वों के गुण उनके परमाणु क्रमांक के आवर्त फलन हैं |
- आधुनिक आवर्त – सारणी में आवर्त की संख्या 7 होती है एवं वर्ग की संख्या 18 होती है |
- हाइड्रोजन की परमाणु संख्या न्यूनतम है अतः इसे आधुनिक आवर्त सारणी में पहले स्थान पर रखा गया है |
- आधुनिक आवर्त सारणी में पहले वर्ग या समूह में क्षारीय धातुओं को रखा गया है | जैसे – लिथीयम , सोडियम , पोटैशियम आदि |
- आधुनिक सारणी के अन्तिम वर्ग ( 18 वाँ ) में अक्रिय गैसों को रखा गया है |
- आधुनिक आवर्त सारणी के बाये भाग में धातुओं को रखा गया | हाइड्रोजन एक अधातु है परन्तु हाइड्रोजन की परमाणु संख्या सबसे कम होने के कारण इसे पहले वर्ग तथा पहले आवर्त में रखा गया है |
- आधुनिक आवर्त सारणी के दायें भाग में धातुओं तथा अधतुओं को रखा गया है |
- प्रत्येक आवर्त का प्रथम सदस्य क्षार – धातु है और अन्तिम सदस्य कोई सक्रिय गैस है | केवल पहले आवर्त का पहला सदस्य हाइड्रोजन ( अधातु ) है जो अपवाद है |
- आधुनिक आवर्त सारणी में वर्ग संख्या नम्बर संयोजी इलेक्ट्रान की संख्या को बतलाता हैं |
- आधुनिक आवर्त सारणी में दो आवर्तों को अलग से सारणी की नीचे रखा गया है , जिसमें लैंथेनाइट व एक्टिनाइट ( 14 – 14 तत्वों ) को रखा गया है |
- किसी आवर्त में बाई से दायीं ओर जाने पर विधुत ऋण आत्मकता और इलेक्ट्रान बन्धुता में वृध्दि होती है |
- वर्ग में नीचे जाने पर धातुओं की क्रियाशीलता में वृध्दि होती है , परन्तु अधातुओं की क्रियाशीलता घटती है |
Buy e-Books : https://yorhelp.shop
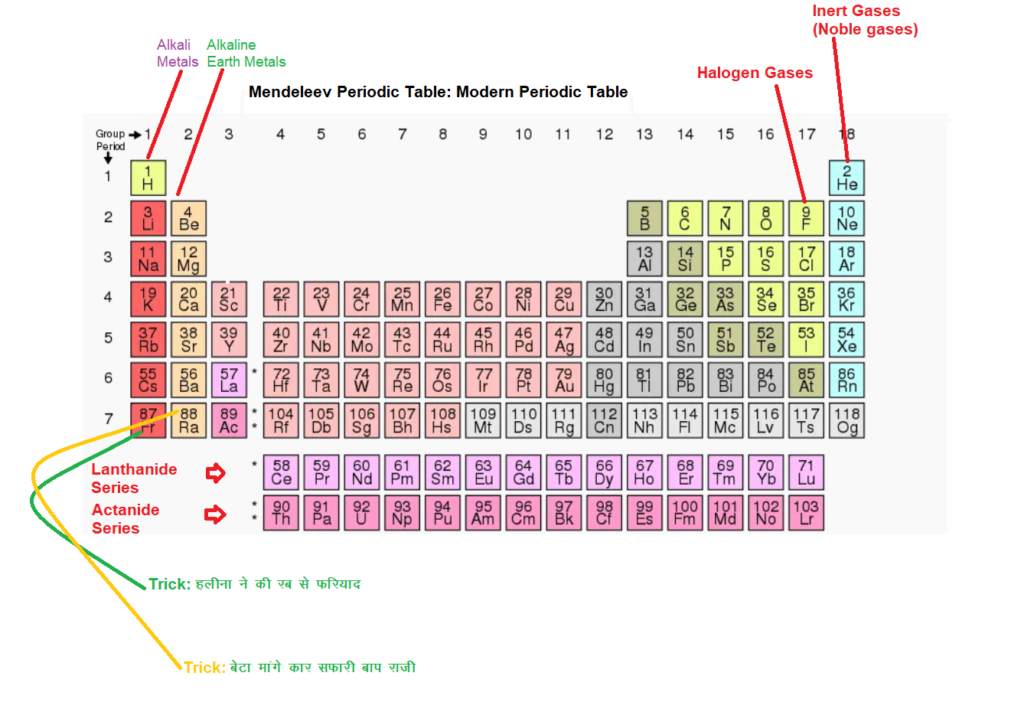
Trick to learn Elements of First and Second Column
Go to this post to learn important 50 General knowledge questions answers in hindi