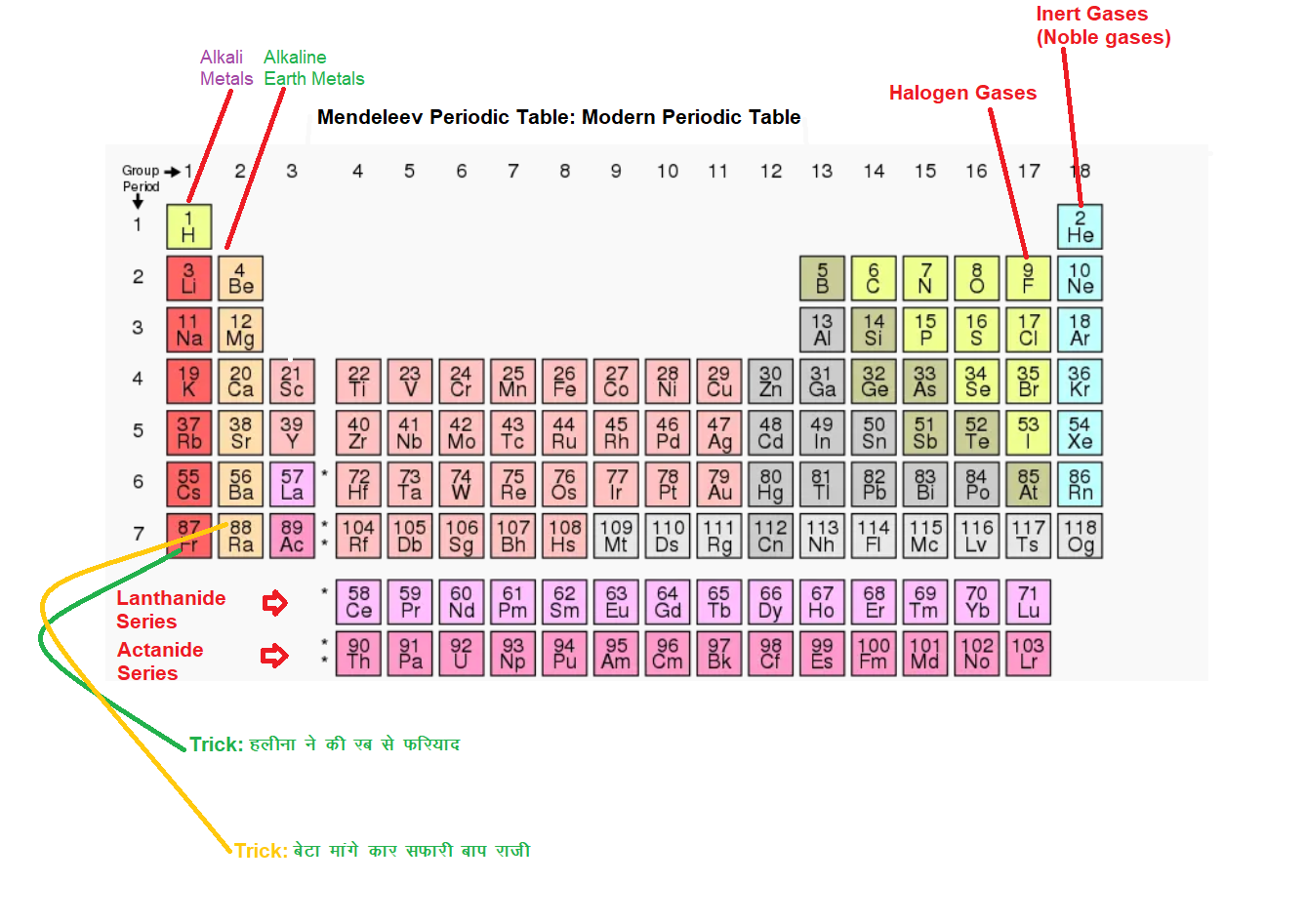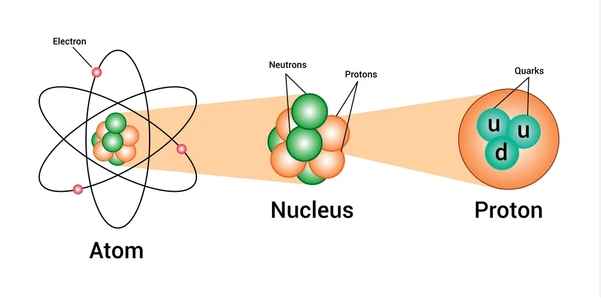
Table of Contents
Here we learn Atomic Model: नील्स बोर का परमाणु माडल, क्वान्टम संख्याएँ , Niels Bohr Atomic Model, Pauli exclusion principle Get ready for UP Board Exam etc
नील्स बोर का परमाणु माडल
इस माडल के अनुसार –
- इलेक्ट्रान , नाभिक के चरों ओर बंद वृत्तीय कक्षाओं में चक्कर लगते हैं | चक्करों के लिए आवश्यक अभिकेन्द्र बल का कार्य ,इलेक्ट्रान और नाभिक के बीच का स्थिर विधुतीय आकर्षण करता है |
- इलेक्ट्रान केवल कुछ निश्चित कक्षाओं में ही चक्कर लगते हैं | इन कक्षाओं की त्रिज्या निश्चित होती है |इन कक्षाओं में घुमते हुए ये इलेक्ट्रान ऊर्जा का विकिरण नहीं करते | इन कक्षाओं को स्थिर कक्षा या ऊर्जा स्तर कहते हैं | इन कक्षाओं को कोश भी कहा जाता हैं |
- जब कोई इलेक्ट्रान कक्षा में चक्कर लगता है , तो न टो ऊर्जा में कमी होती है और न ही वृध्दि होती है |
- इलेक्ट्रान ऊर्जा की निश्चित मात्रा को अवशोषित करके उच्चतर कक्षा में जाता है | इसी प्रकार ,इलेक्ट्रान ऊर्जा की निश्चित मात्रा को उत्सर्जित करके न्यूनतम कक्षा में कूदता है | ऊर्जा की इस निश्चित मात्रा को क्वांटम कहते हैं | एक क्वान्टा का मान हव होता है | ( जहाँ h = प्लांक नियतांक = 6.626*10-34 जूल- से तथा v = आवृति |)
- नाभिक की ओर से प्रारम्भ करके प्रथम, द्वितीय , तृतीय ………….कक्षाओं को क्रमशः 1,2,3,………n अंकों से अथवा K, L, M …………अक्षरों से प्रदर्शित करते है |
परमाणु की कक्षाओं में इलेक्ट्रानों का वितरण
Atomic Model : बोर – बरी की योजना
बोर बरी ने 1921 ई. में विभिन्न कक्षाओं में इलेक्ट्रानों के वितरण के नियम दिए ,जो निम्नलिखित है
- किसी भी कक्षा में उपस्थित अधिकतम इलेक्ट्रानों की संख्या 2n2 होती हैं , जहाँ , n उस कक्षा की संख्या है |
- बाह्यतम कोश में अधिकतम इलेक्ट्रानों की संख्या 8 हो सकती है तथा इसके अन्दर वाले कोश में 18 से अधिक नहीं हो सकती |
- सबसे बाहरी कोश में 2 से अधिक तथा उसके भीतरी कोश अर्थात् (n -2) में 9 से अधिक इलेक्ट्रान तभी हो सकते हैं , जब अंतिम से पहले कोश में इलेक्ट्रानों की संख्या 2n2 हो |
- बाहरी कक्षा में 8 इलेक्ट्रान पूर्ण होने पर फिर नयी कक्षा प्रारम्भ हो जाती है |
बोर – बरी योजना के अपवाद
इलेक्ट्रानों को भरते समय d- अथवा f-कक्षक के पूर्णता या अर्ध्द-पूर्ण भरे होने में यदि केवल एक इलेक्ट्रान कि कमी हो , तो बाह्य कक्षा में से एक इलेक्ट्रान d अथवा f-कक्षक में कूद जाता है | इसका कारण अर्ध्द-पूर्ण तथा पूर्ण भरे उपकोष का अत्यधिक स्थायित्व है |
उदाहरण – cu का इलेक्ट्रानिक विन्यास 2, 8,18, 1 तथा Cr का इलेक्ट्रानिक विन्यास 2, 8, 13,1 होता है |
Atomic Model: कक्षकों में इलेक्ट्रानों के भरने में प्रयुक्त नियम
पाउली का अपवर्जन सिध्दांत
इस सिध्दांत के अनुसार ,एक कक्षक में अधिकतम दो इलेक्ट्रान रह सकते हैं लेकिन उनकी चक्रण की दिशा एक – दूसरे के विपरीत होनी चाहिए |
हुन्ड का नियम
इस नियम के अनुसार , किसी भी उपकोश में इलेक्ट्रानों का युग्मन केवल उस समय प्रारम्भ होता है जब प्रत्येक कक्षक में पहले एक – एक इलेक्ट्रान आ जाये |
आँफबाऊ का नियम
इस नियम के अनुसार “ऊर्जा की तलस्थ अवस्था में , परमाणु अल्पतम ऊर्जा वाले उपकोश में प्रवेश करते हैं |” इस नियम से परमाणु में प्रवेश पाने वाले इलेक्ट्रान द्वारा ग्रहण की जाने वाली ऊर्जा के स्तर का निर्धारण होता है |
इस नियम के अनुसार इलेक्ट्रान उपकोशों के ऊओर्जा स्तरों में निम्न क्रम में प्रवेश पते हैं
1s < 2s < 2p < 3s < 3p < 4s < 3d < 4p < 5s < 4d < 5p < 6s < 4f < 5d < 6p < 7s
Atomic Model: क्वान्टम संख्याएँ
परमाणु के नाभिक के परितः इलेक्ट्रान की स्थिति को परिभाषित करने के लिए चार संख्याओं का प्रयोग किया जाता है , जिन्हें क्वान्टम संख्याएँ कहते हैं |
- मुख्य क्वान्टम संख्या – इससे इलेक्ट्रान की स्थिति तथा ऊर्जा का पता चलता है | यह शून्य को छोड़कर कोई भी भी पूर्ण हो सकती है |
- दिगंशी क्वान्टम संख्या – यह उपकक्षा के आकार को निर्धारित करता है | इसका मान शून्य से ( n – 1 ) तक हो सकता है | l ला कुल मान प्राथमिक क्वान्टम संख्या के बराबर होता है | 0 , 1 , 2 , 3 मान वाली दिगंशी क्वान्टम संख्याएँ क्रमशः s , p , d , f उपकक्षा को दर्शाती हैं |
- चुम्बकीय क्वान्टम संख्या – इसका मान l पर निर्भर करता है | l के दिए गए मान के लिए m का मान -1 से +1 तक कुछ भी हो सकता है |
- चक्रण क्वान्टम संख्या – यह एक इलेक्ट्रान के घुमाव की दिशा को निर्धारित करती है | इसके केवल दो ही मान हो सकते हैं + 1/2 ( अप – स्पिन ) तथा – 1/2 ( डाउन – स्पिन ) |
परमाणु क्रमांक या परमाणु संख्या
मोसले ने 1913 में तत्वों के परमाणु के महत्त्वपूर्ण मौलिक गुण परमाणु क्रमांक या परमाणु संख्या की खोज की | ” किसी तत्व के परमाणु के नाभिक पर उपस्थित समस्त धनावेश की संख्या को परमाणु संख्या या परमाणु क्रमांक कहते हैं |” इसे Z से प्रदर्शित करते हैं |
चूँकि नाभिक में स्थित समस्त धनावेश प्रोटानों की संख्या के बराबर होता हैं अर्थात् यह कक्षा में उपस्थित इलेक्ट्रानों की संख्या के बराबर होता हैं , अतः
परमाणु संख्या = प्रोटानों की संख्या
= इलेक्ट्रानों की संख्या ( उदासीन परमाणु के लिए )
द्रव्यमान संख्या
किसी परमाणु की द्रव्यमान संख्या , उसके नाभिक में स्थित न्यूट्रानों तथा प्रोटानों की संख्या के योगफल के बराबर होती है | इसे ‘A’ से प्रदर्शित करते हैं |
द्रव्यमान संख्या = प्रोटानों की संख्या + न्यूट्रानों की संख्या
द्रव्यमान संख्या = परमाणु क्रमांक + न्यूट्रानों की संख्या
द्रव्यमान संख्या = इलेक्ट्रानों की संख्या + न्यूट्रानों की संख्या
अतः A = Z + N
परमाणु क्रमांक तथा द्रव्य्मान्न संख्या के साथ किसी परमाणु को निम्न प्रकार प्रदर्शित किया जाता है
A = द्रव्यमान संख्या
X = परमाणु का प्रतीक
Z = परमाणु क्रमांक
Atomic Model: रासायनिक संयोग के नियम
द्रव्यमान संरक्षण या द्रव्य की अविनाशिता का नियम
इस नियम को सर्वप्रथम रशियन वैज्ञानिक लामनोसाव ने प्रतिपादित किया था , बाद में लेवोशिए ने पुष्टि की |
इस नियम के अनुसार “द्रव्य अविनाशी है अर्थात् द्रव्य न तो उत्पन्न किया जा सकता है और न ही इसका विनाश किया जा सकता है | ” अतः किसी भी रासायनिक अभिक्रिया में परिवर्तन के उपरांत भी द्रव्य का कुल द्रव्यमान उतना ही रहता है जितना अभिक्रिया से पुर्व था |”
उदाहरण – AgNO3 + NaCl AgCl + NaNO3
क्रिया से पहले AgNO3 तथा NaCl का संयुक्त द्रव्यमान क्रिया के पश्चात् प्राप्त AgCl तथा NaNO3 के संयुक्त द्रव्यमान के बराबर होगा |
स्थिर अनुपात का नियम
यह नियन फ्रांस के वैज्ञानिक प्राउस्ट ने प्रतिपादित किया था | इस नियम के अनुसार “प्रत्येक रासायनिक यौगिक में ,चाहे वह किसी भी विधि द्वारा किसी भी परिस्थिति में ,किसी भी स्थान पर बनाया जाए , उपस्थित तत्वों के द्रव्यमान एक निश्चित अनुपात में संयुक्त रहते हैं |”
उदाहरण – जल ( H2O ) , हाइड्रोजन और ऑक्सीजन से बना यौगिक है | यह नदी ,समुद्र , कुएँ ,वर्षा या किसी भी रासायनिक विधि से प्राप्त किया जा सकता है | इसका विश्लेषण करने पर ज्ञात होता है कि जल में सदैव हाइड्रोजन तथा ऑक्सीजन तत्व द्रव्यमान के अनुसार 1:8 के अनुपात में संयोग करते हैं |
गुणित अनुपातत का नियम
इस नियम को 1803 ई. में जॉन डाल्टन ने प्रतिपादित किया था | इसके अनुसार “जब दो तत्व परस्पर रासायनिक अभिक्रिया संयोग करके दो या दो से अधिक यौगिक बनाते हैं , तब एक तत्व के समान द्रव्यमान से संयोग करने वाले दुसरे तत्व के विभिन्न द्रव्यमानों में एक सरल गुणित अनुपात होता है |”
उदाहरण – कार्बन तथा ऑक्सीजन परस्पर संयोक करके दो यौगिक कार्बन मोनोक्साइड (CO)तथा कार्बन डाइऑक्साइड ( CO2 ) बनाते हैं | इनमें कार्बन की निश्चित मात्रा अर्थात् 12 ग्राम से संयोग करने वाली ऑक्सीजन का द्रव्यमान क्रमशः 16 तथा 32 ग्राम है |
ऑक्सीजन की यह मात्रा 1:2 से सरल अनुपात में है |
व्युत्क्रम या तुल्य अनुपात का नियम
इस नियम को 1792 ई. में एक जर्मन वैज्ञानिक रिक्टर ने प्रतिपादित किया था | इसके अनुसार ” जब दो तत्वों के भिन्न – भिन्न द्रव्यमान अलग – अलग किसी तीसरे तत्व के निश्चित द्रव्यमान से संयोग करते हैं और यदि इन दोनों तत्वों में कभी संयोग हो सके ,तो वे उसी अनुपात में अथवा इसके सरल गुणित अनुपात में संयोग करेगें ,जिसमें वे तीसरे तत्व के एक निश्चित द्रव्यमान से संयोग करते हैं |
उदाहरण – कार्बन , हाइड्रोजन से संयोग करके मेथेन तथा ऑक्सीजन से संयोग करके कार्बन डाइऑक्साइड बनता है | इन यौगिकों में कार्बन के निश्चित द्रव्यमान अर्थात् 12 ग्राम से संयोग करने वाले हाइड्रोजन एवं ऑक्सीजन तत्वों के द्रव्यमानों में 4:32 या 1:8 का अनुपात है अतः जब हाइड्रोजन एवं ऑक्सीजन संयोग करके जल बनाते हैं , तो जल में हाइड्रोजन तथा ऑक्सीजन 1:8 के अनुपात में होते हैं |
गै-लुसैक का गैसीय आयतन सम्बन्धी नियम
समान ताप एवं दाब पर , यदि गैसे एक दूसरे से क्रिया करेन और क्रियाफल भी गैस हो , तो क्रियाकारी तथा क्रियाफल गैसों के आयतनों में सरल अनुपात होगा
उदाहरण – N2 + H 2NH3
1 आयतन 3 आयतन 2 आयतन
यहाँ 1 आयतन नाइट्रोजन , 3 आयतन हाइड्रोजन से क्रिया करके 2 आयतन अमोनिया बनती है |
- Atomic Model: महत्त्वपूर्ण तथ्य
- https://yorhelp.in/top-20-general-science-questions-with-answers-general-knowledge/
द्रव्य की अविनाशिता का नियम नाभिकीय अभिक्रियाओं के लिए सत्य नहीं है |
भिन्न – भिन्न ऑक्सीजन संख्या दर्शाने वाली धातुओं के लिए स्थिर अनुपात का नियम सत्य नहीं है |
समस्थानिकों के लिए भी स्थिर अनुपात का नियम सत्य नहीं है |
नाइट्रोजन के पाँच ऑक्साइड रासायनिक संयोग के गुणित अनुपात के नियम की व्याख्या करते हैं |
Follow the link https://yorhelp.shop to buy motivational and life changing eBooks.